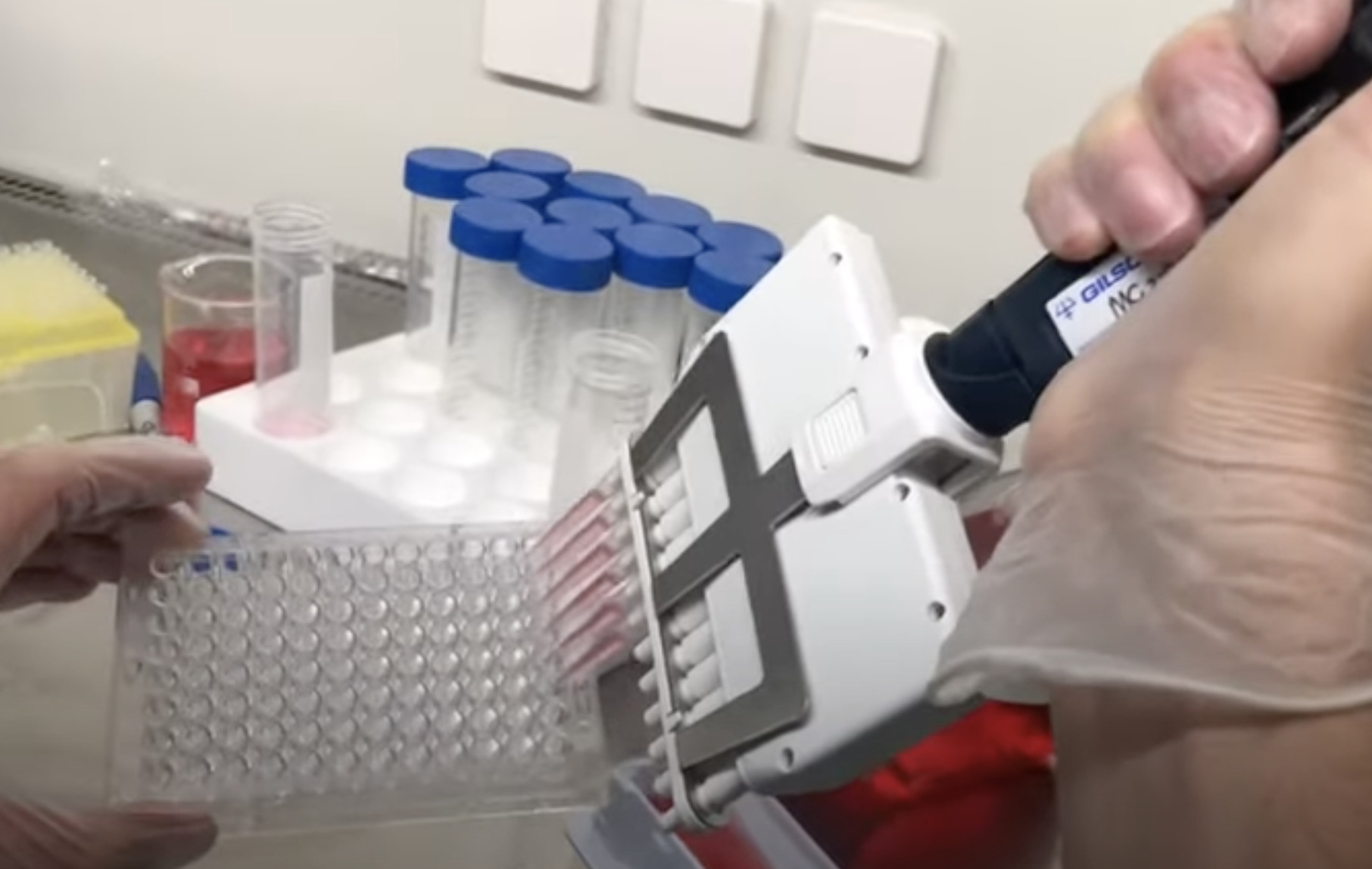
После того, как проведена малотравматичная липосакция под местной анестезией, аспират поступает в лабораторию для обработки. Применяют механический (редко) и ферментативный (часто) способ выделения клеток. Мы (CIRM) используем а наших клиниках ферментативный способ. После обработки и наращивания количества клетки подвергаются специальной обработке и затем вводятся пациенту в виде инфузии.
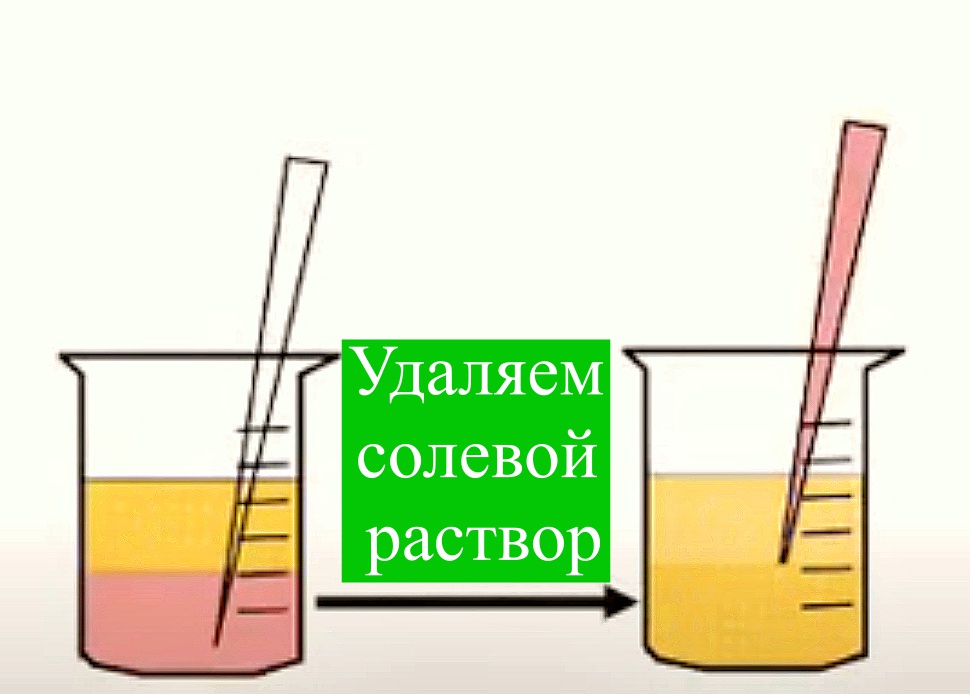
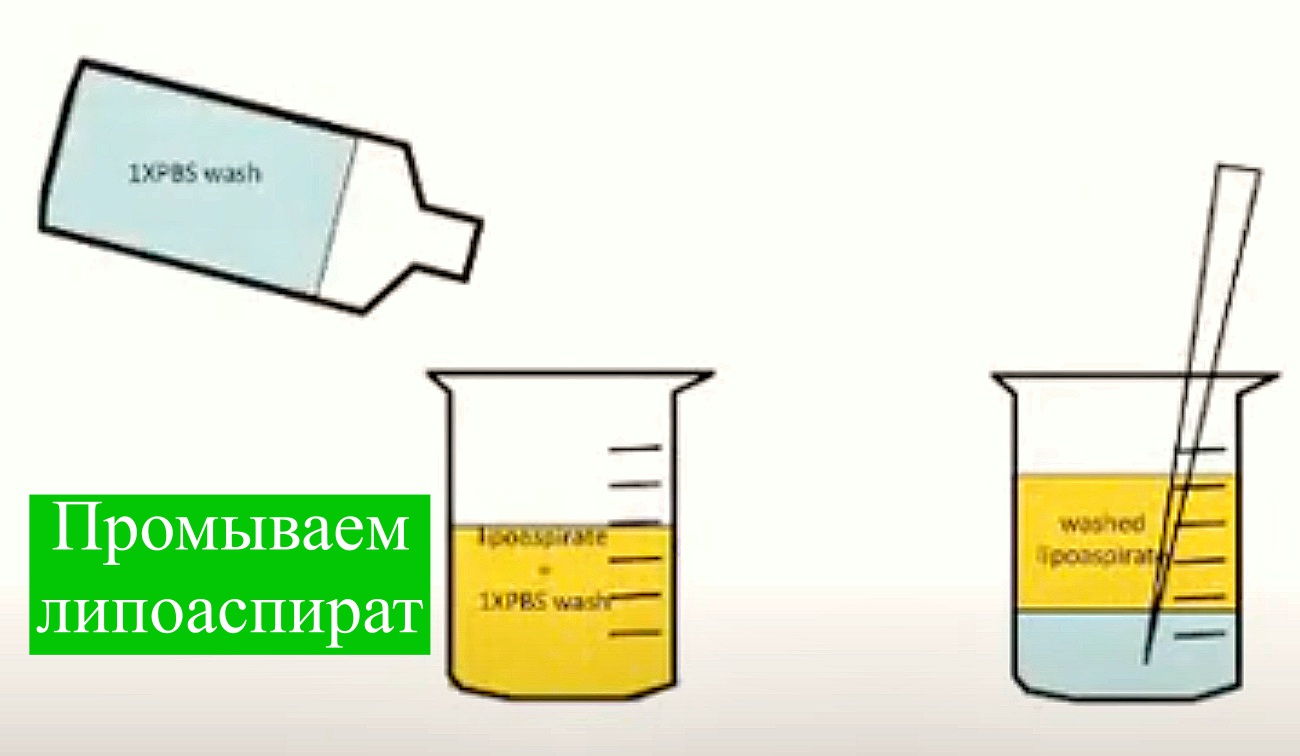
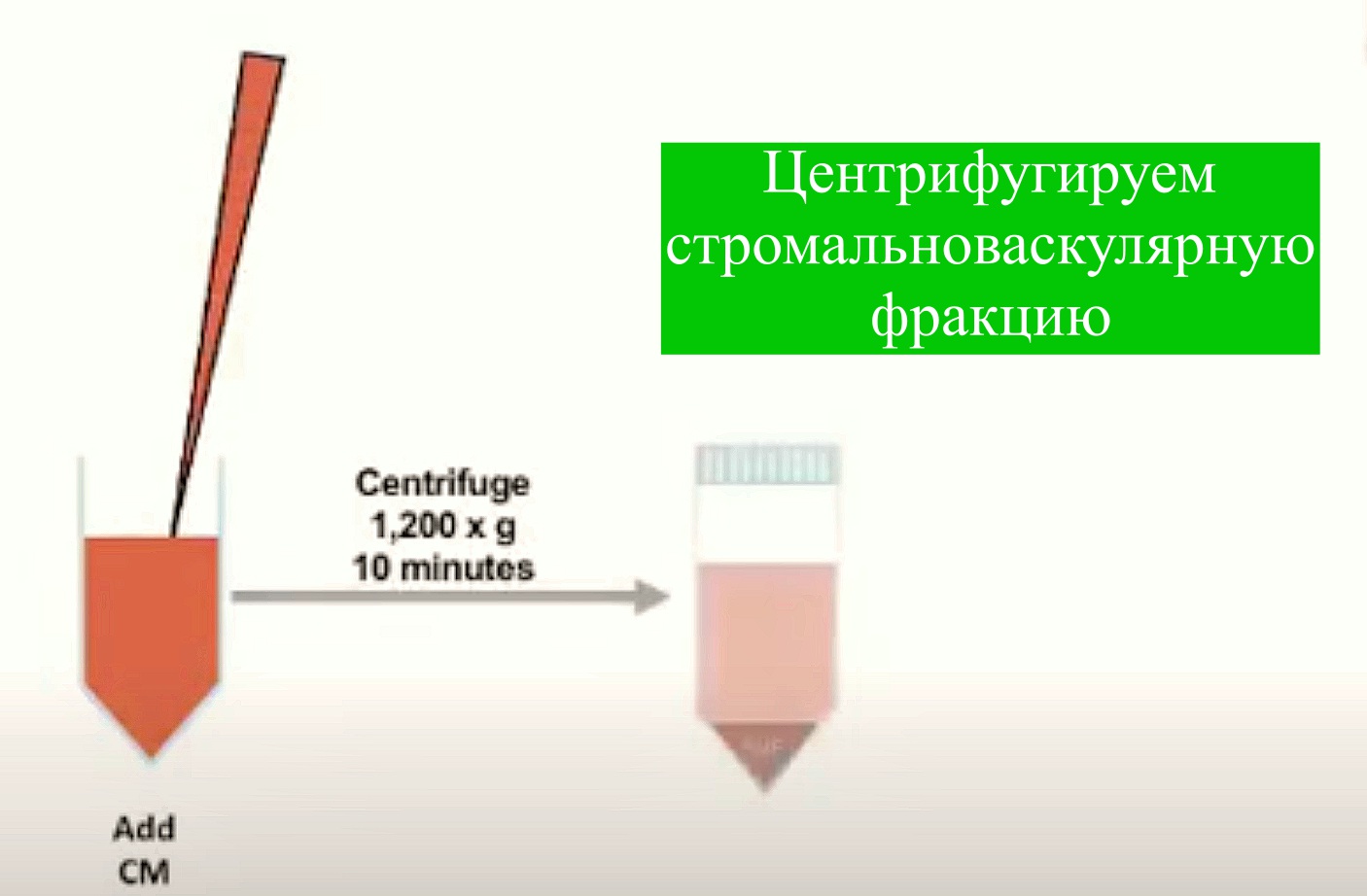
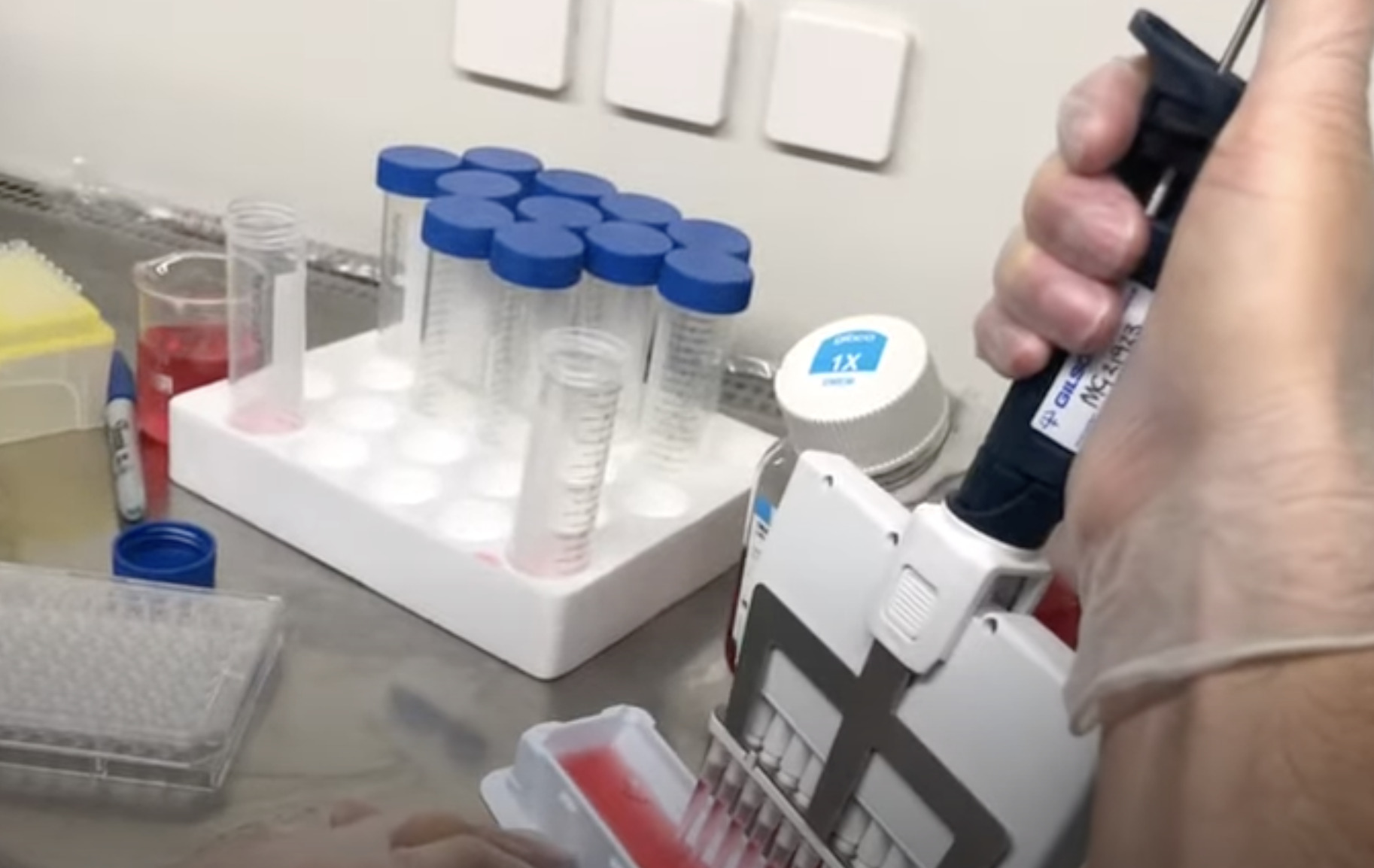
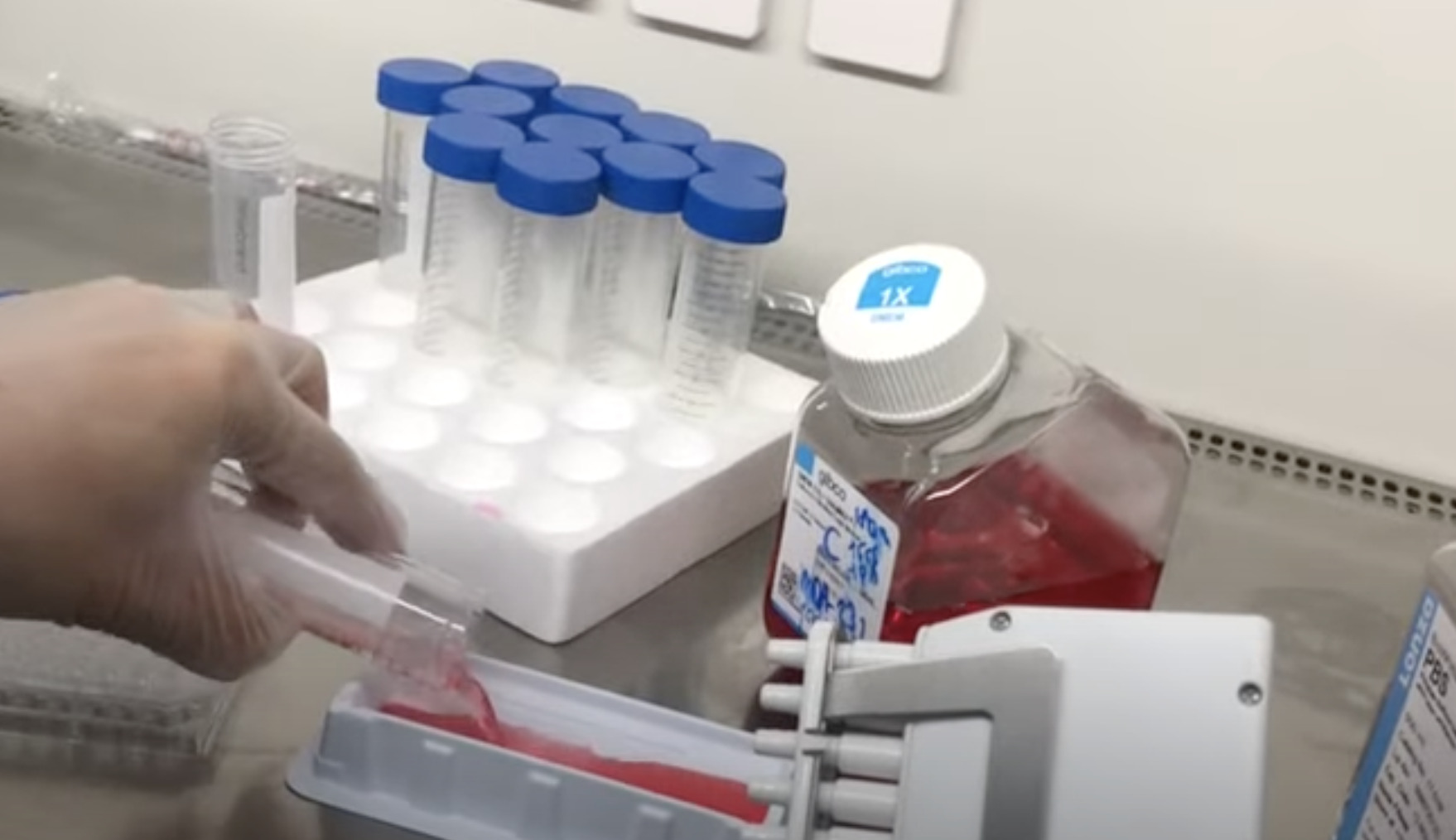
Жировую ткань получают (300 мл и более) под местной анестезией при косметической липосакции, липоаспирации подкожного жира или путем эксцизии жировых отложений. Полученные образцы помещают во флаконы с базовой культуральной средой DMEM, содержащей 4,5 г/л глюкозы, 2мМ глутамин, и транспортируют во льду к месту выделения. Образцы должны быть использованы незамедлительно, допускается хранение в течение дня при 4 0С. Фрагменты полученной жировой ткани отмывают фосфатно-солевым буфером, измельчают и инкубируют с 0,075 % раствором коллагеназы I типа при 37 °С в течение 30-60 мин для дезинтеграции клеток. Инактивацию коллагеназы проводят добавлением равного объема культуральной среды DMEM, содержащую 10 % эмбриональной бычьей сыворотки (FBS). Полученную суспензию клеток центрифугируют при 400 х g в течение 5 мин, с получением двух фракции: в верхней располагаются адипоциты, а в осадке – стромально-васкулярные клетки с примесью гемопоэтических клеток. Полученный осадок ресуспендируют в среде DMEM/10% FBS и фильтруют через 100-μm нейлонный фильтр для удаления клеточного дебриса. Фильтрат центрифугируют повторно. Удаление эритроцитов проводят с помощью инкубации в лизирующем растворе хлорида аммония. Оценивают жизнеспособность полученных клеток с витальным красителем (трипановый синий), подсчитывают количество клеток
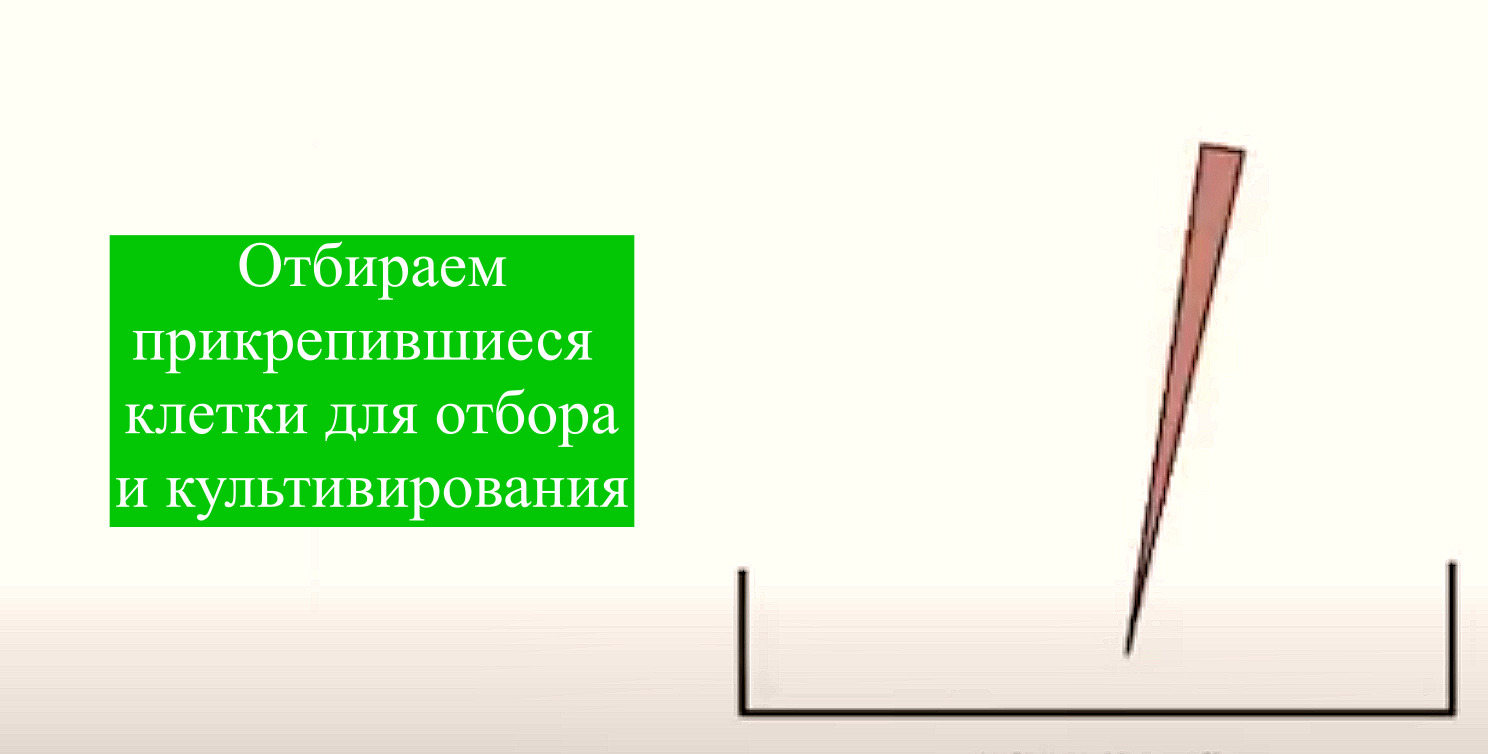
Полученные клетки помещают в культуральные 225-см2 Т-флаконы с плотностью 20 тыс. клеток на см2 и культивируют в 35 мл базовой среды DMEM/FBS (10%), с добавлением 1% антибиотика/антимикотика в СО2-инкубаторе при 37 0С, 5% СО2 и относительной влажности 95 %. Через 3 дня проводят смену культуральной среды. Первичная культура адгезивных клеток жировой ткани состоит из морфологически различающихся клеток, что связано с разнообразием исходного клеточного состава. В процессе монослойного культивирования происходит постепенное удаление слабоадгезивных клеток, и на 5-е сутки культивирования наблюдают равномерный рост клеток по всей поверхности культурального пластика. На 10–12-е сутки культивирования адгезивные клетки стромально- васкулярной фракции жировой ткани формируют 70–80% конфлюэнтного монослоя. После достижении конфлюентного монослоя клетки снимают с подложки, используя 0,25% раствор трипсина- ЭДТА, обозначают как пассаж Р0 и пересевают для дальнейшей экспансии. В ходе субкультивирования время достижения конфлюентного монослоя составляет в среднем 3 суток на протяжении 5 пассажей. При этом гетерогенность исходной суспензии постепенно снижается, и уже после 3–4 пассажей культура МСК жировой ткани представлена популяцией преимущественно фибробластоподобных клеток. В ходе каждого пассажа количество клеток увеличивается в среднем в 2 раза.
Для хранения МСК жировой ткани снятые с подложки клетки пассажа Р0 осаждают центрифугированием при низких скоростях, затем ресуспендируют в базовой среде DMEM/FBS (10%), делят на 3 объема, и помещают в пробирки с раствором для криоконсервации, содержащий DMEM/FBS (80%), диметилсульфоксид (ДМСО). Все процедуры проводят в стерильных условиях. Пробирки с клетками замораживают температуре при -80 0С в течение суток, затем перемещают в жидкий азот для хранения.
Для возобновления клеточной культуры МСК из замороженных клеток пассажа 0, пробирки быстро размораживают на водяной бане при температуре 37 С0. Клеточную суспензию делят на 3 культуральных Т-флакона 225см2 и культивируют в среде DMEM/10% FBS в СО2-инкубаторе при 37 0С, 5% СО2 и относительной влажности 100 % в течении 24 часов. Затем проводят смену культуральной среды для удаления ДМСО (содержащегося в среде для криоконсервации), продолжают культивировать до достижения конфлюэнтного монослоя, проводят смену среду каждые 3 суток.
Для характеристики клеточного фенотипа МСК жировой ткани проводят анализ экспрессии поверхностных белков и внутриклеточных маркеров с использованием методов проточной цитофлуометрии. Показано, что МСК костного мозга и жировой ткани имеют сходную фиброласто- подобную морфологию и характерный клеточный фенотип CD 90+, СD 105+, CD 44+, CD 119+, CD 34-, CD 45-, CD 31 -, CD14-. Noel D. с соав. показали одинаковую способность к дифференцировке в остеогенном и хондрогенном направлениях МСК жировой ткани и костного мозга in vitro и in vivo. Однако некоторыми авторами отмечается разная способность МСК к дифференцировке. Так, Bochev I. c соав., исследуя МСК костного мозга и жировой ткани в одинаковых условиях in vitro, установили, что они демонстрируют практически идентичные морфологические, иммунофенотипические, колониеобразующие свойства и способность к дифференцировке в адипогенном направлении. Однако, МСК жировой ткани проявляли меньший потенциал к дифференцировке в остеогенном направлении, чем МСК костного мозга.