На сегодняшний день существует большое количество публикаций и исследований, которые демонстрируют необходимость индивидуального подхода к терапии сахарного диабета, о чем мы заявляли еще в 1995 году. К сожалению, в РФ до сих пор используется устаревший подход заместительной терапии препаратами инсулина для всех групп пациентов даже тогда, когда этого не требуется и связано не с ошибками в диагностике, а неверным изначальным подходом к стадированию заболеванию и определении определенной фазы для терапии.
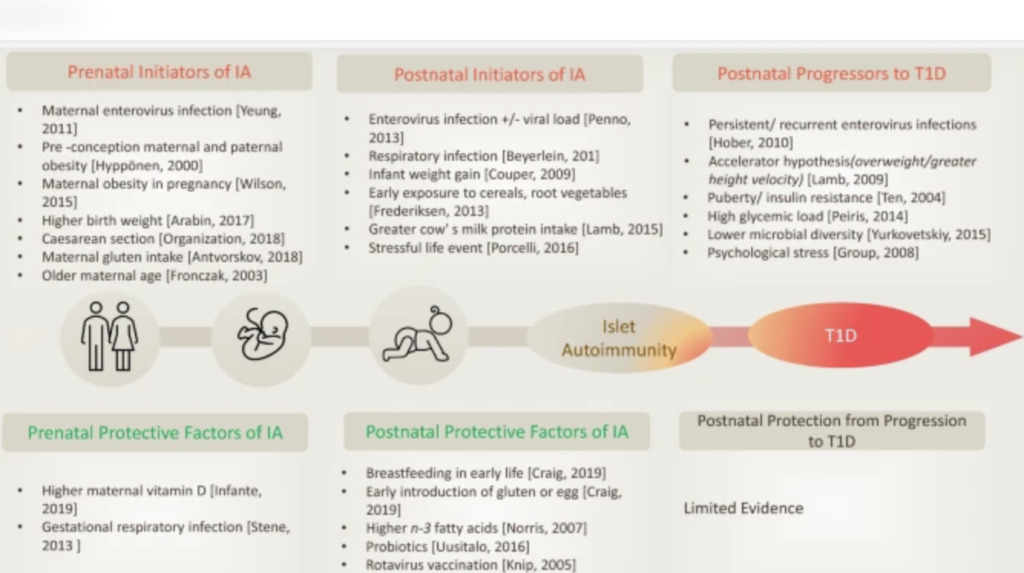
Множество факторов, которые могут привести к развитию и проявлению СД1, лежат в основе клинической гетерогенности заболевания. Комбинации полиморфизмов генов и триггеров окружающей среды, которые влияют на риск развития СД1 и приводят к развитию заболевания, чрезвычайно высоки. Проспективные когортные исследования способствовали выявлению потенциальных триггеров островкового аутоиммунитета (ИА) и естественного течения прогрессирования до СД1. Возможные триггеры, такие как инфекции, диета в раннем возрасте, уровень витамина D, состав кишечной микробиоты, прививки, загрязняющие вещества и токсины и географические различия при сочетании с генетической предрасположенностью и специфическими эпигенетическими модификациями, инициируют аутоиммунное разрушение β-клеток поджелудочной железы. Эти триггеры необходимо регистрировать проспективно в хорошо спланированных исследованиях, а не вспоминать их ретроспективно во время постановки диагноза СД1 пару лет спустя.
Когда начинается процесс аутоиммунитета β-клеток, развитие клинического СД1 можно разделить на три основных этапа: (I) бессимптомный аутоиммунитет β-клеток, определяемый наличием ≥ 2 типов аутоантител, таких как GAD65 (GADA), транспортер цинка 8 (ZnT8A), инсулин (IAA), антитела к островковым клеткам (ICA), белки, ассоциированные с инсулиномой (IA-2A и IA-2β), при нормогликемии; (II) бессимптомный аутоиммунитет β-клеток, характеризующийся наличием ≥ 2 типов аутоантител, но с дисгликемией, указывающей на функциональное повреждение β-клеток). Последовательность событий от появления аутоиммунитета до дисгликемии, а затем до явного диабета происходит вдоль этого предсказуемого курса, но продолжительность каждой стадии может широко варьироваться у разных людей.
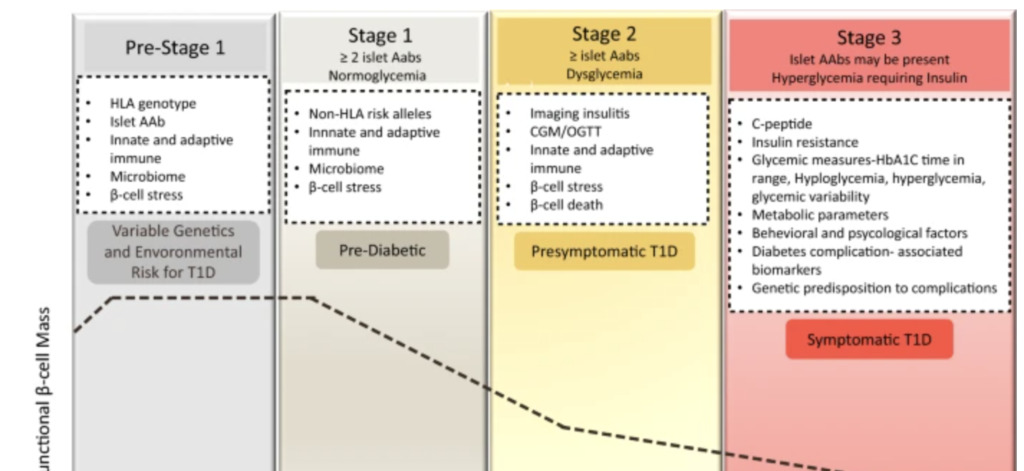
Развитие и стадирование сахарного диабета 1 типа. T1D характеризуется постепенной потерей функции β-клеток (черная пунктирная линия) с течением времени. По мере прогрессирования заболевания функция бета-клеток падает ниже порога, необходимого для поддержания контроля уровня глюкозы, что требует заместительной терапии инсулином. Генетический риск и риск окружающей среды включены в этиологию заболевания. На стадии 1 аутоантитела к β-клеткам сохраняются, но сохраняется нормогликемия и отсутствуют клинические симптомы. На стадии 2 количество аутоантител к β-клеткам может вызывать дисгликемию, но без каких-либо симптомов диабета. На стадии 3 преобладают аутоантитела к β-клеткам и появляются явные симптомы диабета. В белых прямоугольниках указаны категории биомаркеров, которые можно использовать для уточнения парадигмы стадирования, улучшения прогностических прогнозов.
Тщательное лечение диабета, начатое после постановки диагноза симптоматического СД1, увеличивает вероятность фазы медового месяца, помогает пациентам сохранить более высокие уровни С-пептида и снизить уровень смертности, что указывает на то, что пациенты, которые лечатся раньше, будут иметь лучшие долгосрочные результаты. Кроме того, дети с генетическим риском из когорты DAISY (исследование аутоиммунитета у молодых людей) имели более низкие уровни HbA 1C , поддерживаемые в пределах нормального диапазона, что намного ниже, чем средние уровни HbA 1C у детей с СД1 в сообществе. Только 3% детей DAISY были госпитализированы с диагнозом СД1 по сравнению с 44% детей в сообществе.
Диагноз СД1 исторически ставился на основании обнаружения нарушения регуляции уровня глюкозы в крови; однако это привело к тому, что пациенты с различными фоновыми патологиями были сгруппированы и лечились вместе. Доказательства разрушения β-клеток через присутствие анти-островковых аутоантител (которые могут распознавать инсулин, декарбоксилазу глутаминовой кислоты 65 (GAD65), изоформу транспортера цинка 8 (ZnT8) или антиген островковых клеток (ICA512) и возраст, в котором начальный аутоантитела являются важными факторами, характеризующими «классический» этиологический подтип СД 1. Однако реже гипогликемия может быть вызвана потерей функции или мутацией de novo в спорадическом гене, что приводит к моногенному диабету, что составляет 3% все случаи диабета у детей и взрослых.
Гетерозиготная активация генов, кодирующих АТФ-зависимую субъединицу калиевого канала Kir6.2, вызывает перманентный неонатальный диабет в дополнение к некоторым неврологическим аномалиям у некоторых больных. Отличие моногенного диабета от СД1 имеет решающее значение для точной диагностики, применения правильного лечения, «например, препаратов сульфонилмочевины при мутации Kir6.2», и в будущем для разделения этих пациентов на группу, которая, скорее всего, получит пользу от генной терапии, нацеленной на мутацию.
Повышению точности диагностики классического СД1 по сравнению с моногенным СД1 способствовало введение шкалы геномного риска (GRS), которая оценивает индивидуальный риск СД1 на основе наличия у него набора нескольких (10–40) вариантов риска СД1.
СД1 и диабет 2 типа (СД2) часто различают в зависимости от того, является ли человек с нарушением регуляции уровня глюкозы в крови молодым и имеет здоровый вес (типично для СД1) или пожилым человеком с ожирением (типично для СД2). Однако эти два проявления имеют разные причины и требования к лечению. Исследования 2017 года показали, что примерно 40% людей, у которых развился СД1 после 30 лет, изначально были диагностированы и лечились от СД2. Учитывая потенциально опасный для жизни характер инсулинодефицитного состояния, эти результаты требуют более широкого использования тестирования аутоантител для различения СД1 и СД2, а также широкого признания того факта, что одни только клинические признаки не могут надежно отличить эти два состояния.
Вот почему стандартные подходы принятые повсеместно не подходят для персонифицированной терапии СД 1 типа. Именно поэтому, мы изначально подходили к каждому случаю индивидуально при маршрутизации пациентов, этим объясняется не поголовное применение высокотехнологичных методов (клеточная терапия стволовыми клетками) или генная терапия, а строго индивидуальное использование.
translational-medicine.biomedcentral.com/articles/10.1186/s12967-021-02778-6

